-
 Introducción
IntroducciónLa ulceración del pie es una complicación significativa de la diabetes con una incidencia anual ligeramente superior al 2% en todos los pacientes con diabetes, la cual se eleva entre 5.0 y 7.5% en los que presentan neuropatía periférica.[I] Se estima que un 15% de los pacientes con diabetes desarrollarán úlceras en algún momento de su vida. La mortalidad a los 5 años de los pacientes a los que se les practica una amputación de miembros inferiores es de 50-60%.[II]
El tratamiento de un paciente con úlceras del pie diabético incluye lo siguiente: control metabólico, eliminción de los sitios de presión, desbridamiento del tejido necrótico, empleo de apósitos y el tratamiento antimicrobiano de las infecciones. Además debe evaluarse la posible indicación de otras terapias más específicas como los injertos de piel o los sustitutos artificiales de piel obtenidos por técnicas de ingeniería de tejidos, los factores de crecimiento y el empleo de métodos de revascularización. No obstante, esta complicación constituye un problema médico no resuelto ppues un número importante de pacientes evolucionan a la amputación especialmente aquellos con lesiones en los grados avanzados.
El Heberprot-P® es un medicamento desarrollado por el Centro de Ingeniería Genética y Biotecnología de La Habana (CIGB) para tratamiento de las úlceras del pie diabético (UPD). Este producto, basado en factor de crecimiento epidérmico humano, recombinante (rhuEGF), con el cual el CICB tiene una larga tradición productiva, estimula la pproliferación de fibroblastos, queratinocitos y células endoteliales de vasos, lo cual contribuye a sus propiedades cicatrizantes.
-
 Propiedades
PropiedadesPropiedades Físicas, Químicas y Farmacéuticas
Categoría Farmacológica:
Agente estimulante de la cicatrización y citoprotector.
Nombre comercial:
Heberprot-P®Nombre Genérico:
Factor de crecimiento epidérmico humano recombinante (FCEhrec)
Nombre Químico:
Factor de crecimiento epidérmico humano recombinante (FCEhrec)
Similar Comercial: No existe.
Forma farmacéutica:
Inyectable presentado en forma liofilizado en bulbos de vidrio.Vía de administración:
Administración parental, por vía intralesional y perilesional.Características del Envase: El producto se presenta en:
Frasco ampolla de vidrio hidrolítico, incoloro, tapón de goma, precinto de aluminio y tapa flip off.
Estuche múltiple para 6 ampollas de vidrio I incoloro de Heberprot-p®.Se presneta en dosis de 75 μg.
Composición del producto: Cada bulbo de 5 ml contiene:
Factor de Crecimiento Epidérmico humano recombinante (FCEhr) 0,075mg
Sacarosa 15,000 mg
Dextran 40 5,000 mg
Hidrogenofosfato de disodio 0,454 mgDihidrogenofosfato de sodio dihidratado 1,061mg
Agua para inyección 5ml
Condiciones de almacenamiento:
Consérvese a temperatura de 2º C a 8º C. -
 Farmacología
FarmacologíaEl efecto del Factor de Crecimiento Epidérmico (FCE) ha sido ampliamente estudiado en el proceso de cicatrización. El mismo es una molécula proteica, sencilla, que tiene un peso molecular de 6045 daltons, un punto isoeléctrico de 4.6 y consta de 53 aminoácidos. Estimula tanto la proliferación de fibroblastos como de células epiteliales. Presenta potente actividad mitogénica in-vivo sobre las células epidérmicas, musculares lisas de los vasos, fibroblastos y queratinocitos, entre otras.
Los primeros efectos biológicos atribuidos al FCE fueron la apertura precoz de los párpados y la erupción temprana de la dentición cuando se administraba por vía parenteral a ratones recién nacidos. Posteriormente fue aislado por Cohen y Carpenter de la orina humana y después de esto se ha reportado su detección en varios de los fluidos del organismo humano como suero, saliva, jugo gastroduodenal, calostro, líquido amniótico y seminal.
Propiedades FARMACOCINÉTICAS (absorción, distribución, biotransformación, eliminación):
Los niveles fisiológicos de FCE en plasma no son detectables, pero las plaquetas contienen niveles sustanciales (aproximadamente 500 pmol/ 1012 plaquetas). Después de la coagulación, las concentraciones de FCE alcanzan los 130 pmol/L, lo cual es suficiente para inducir la mitosis y migración celular. Esta molécula regula el crecimiento, la diferenciación y metabolismo de varias células.
Estimula la migración y proliferación de fibroblastos que permiten la síntesis y depósito de colágeno. También son quimioatrayentes y mitógenos de células endoteliales y epiteliales.
Los perfiles farmacocinéticos (FK) del 125I-FCEhr administrado, su distribución en órganos y vías de eliminación han sido objeto de análisis. Se realizaron estudios en ratas y perros tras una administración única, tanto por vía tópica como endovenosa. Los mayores niveles, expresados en ng equivalentes por gramo de tejido, se alcanzaron en riñones, hígado, piel y estómago. Según los datos de radiactividad, a las 96 horas se detecta aún eliminación de un valor correspondiente al 78 % del producto en la orina. El comportamiento cinético del FCEhr tras la administración i.v. se caracteriza por una rápida fase de distribución seguida de una fase de eliminación más lenta, tanto para sangre como para plasma. Se ha demostrado que el hígado y el riñón son los dos órganos clave responsables de la fase rápida de distribución. La concentración sanguínea resultó siempre inferior a la plasmática.
El FCEhrec no se distribuye en la fracción celular sanguínea, hecho esperable por la conocida carencia de receptores en estas estirpes celulares. El FCEhr sufre una rápida e importante degradación en el organismo antes de ser excretado por la orina, principal vía de eliminación según estos resultados. Se ha planteado que el riñón es el principal órgano que participa en la captación y el metabolismo de FCEhr. Apenas existe paso del FCEhr a la circulación cuando se administra tópicamente, tanto en los animales con piel intacta como en los que sufrieron lesión.
En un estudio de farmacocinética después de la administración intralesional de Heberprot-P® 25 μg o 75 μg, 3 veces por semana en pacientes con úlceras de pie diabético grados 1 y 2 de Wagner se alcanzaron los niveles plasmáticos de FCEhr máximos a los 5-15 minutos de administrado (Tmax.). La eliminación fue rápida, en alrededor de 2 horas. Los valores promedio de AUC para 25 μg fueron 85.1 pg.h/ mL, tanto después de la primera (período I), como después de haber recibido más de 15 administraciones (período II), mientras que para 75 μg fueron 197.8 y 243 pg.h/ mL en los períodos I y II respectivamente, lo que indica que no hubo acumulación de FCEhr durante el tratamiento. No se observaron diferencias entre las dosis en los t1/2 ni en el tiempo de residencia medio en el cuerpo, próximos a 1 hora. No se detectó en orina aumento en la eliminación de FCEhr en las 48 horas siguientes a la administración, comparado con el grupo que recibió placebo, por lo que el FCEhr en orina debe corresponder al producido endógenamente. En este estudio se obtuvo cierre total de las úlceras en el 87.5 % de los pacientes a las 12 semanas después de iniciado el tratamiento con cualquiera de las dosis.
Propiedades FARMACODINÁMICAS
El FCE ejerce su acción mediante la unión a un receptor específico ubicado en la membrana de las células blanco. El receptor es una glicoproteína con actividad tirosina quinasa. Se ha reportado la presencia de este receptor en varias líneas celulares humanas excepto en las células hematopoyéticas. Se encuentra en abundancia relativa en la piel.
Varios estudios de farmacodinamia experimental se han realizado aplicando el FCEhr por vía parenteral en los que se han puesto de manifiesto su papel protector y trófico. En ratas sometidas a una axotomía total transversal del nervio ciático a la altura de la región coxofemoral se demostró el efecto neuroprotector de la inyección perilesional de FCEhr mediante la estimulación de la respuesta de regeneración morfofuncional del axón y de síntesis de mielina por el nervio y sus células. En dos estudios independientes y extemporáneos se demostró que el tratamiento: a) favoreció el restablecimiento de la conducción nerviosa motora a los 60 días de provocado el trauma después de un tratamiento con FCEhr durante 20 días; b) favoreció la recuperación del axón y de la mielina y previno o atenuó los cambios sugerentes de degeneración intraxonal; c) previno o postergó el debut de cambios tróficos de los tejidos blandos de la extremidad (piel y anejos) como la aparición de úlceras plantares y la necrosis de los dedos.
En dos estudios realizados en roedores, en un caso con quemaduras hipodérmicas de aproximadamente 8-9 % y en otro de daño multiorgánico inducido por tioacetamida, se obtuvo disminución de la letalidad y menor magnitud del daño gastrointestinal y renal en los animales tratados con una dosis de 30 μg/ kg de FCEhr intraperitoneal, con respecto al control. Por otro lado, se ha evidenciado protección dosis-efecto del FCEhr en modelos de daño hepático y de isquemia/ reperfusión en riñón, al ensayar dosis de 500 y 750 μg/ Kg por vía peritoneal. Los marcadores de estrés oxidativo, como el malonil dialdehído, fueron significativamente menores en los grupos tratados.
En biopsias del tejido de granulación de pacientes tratados con el Heberprot-P® se ha observado neoangiogénesis de microvasculatura en casos isquémicos y una reacción proliferativa en los neuropáticos.
-
 Experiencia clinica
Experiencia clinicaIndicaciones terapéuticas
Sólo debe usarse bajo PRESCRIPCIÓN FACULTATIVA
El Heberprot-P® está indicado, junto a otras terapias convencionales, para el manejo del pie diabético en pacientes con úlceras neuropáticas e isquémicas, con un área superior a 1 cm2, para estimular la formación de tejido de granulación útil que permita el cierre por segunda intención o mediante autoinjerto de piel según ha sido demostrado en varios estudios clínicos.
En el primer estudio piloto en 14 pacientes con úlceras de pie diabético entre 21 y 78 cm2, grados 3 y 4 según la clasificación de Wagner, la mayoría isquémicos y sin otra alternativa terapéutica, se administró Heberprot-P® 25 μg por vía intralesional, 3 veces/ semana, hasta lograr la formación de tejido de granulación o un máximo de 20 aplicaciones. Se obtuvo respuesta total (>75 % de la superficie de la úlcera cubierta por tejido de granulación) en 7 (50 %) pacientes en 33 días como promedio, quienes lograron el cierre completo de la lesión (en 57 días como promedio) y la prevención de la amputación. Solamente se observó recurrencia en un paciente luego del seguimiento de un año. El producto fue seguro, reportándose como principal evento adverso el dolor en la zona de inyección.
Seguidamente se realizó un ensayo multicéntrico, a doble ciegas, aleatorizado entre los niveles de 25 μg y 75 μg en cada aplicación, tres veces por semana hasta la granulación completa u ocho semanas. Se incluyeron 41 pacientes, con lesiones con una extensión de más de 20 cm2 como mediana, grados 3 y 4 según Wagner, más del 50 % isquémicos. Se obtuvo respuesta completa de granulación en el 82.6 % y 61.1 % de los pacientes a las 3.8 y 4.9 semanas de tratamiento como mediana en los grupos de 75 μg y 25 μg respectivamente. La epitelización completa a las 20 semanas después del inicio del tratamiento ocurrió en el 56 % y 50 % de los pacientes. En el seguimiento al año un paciente del grupo de 75 μg tuvo recidiva de la lesión. Se concluyó que el producto es efectivo y seguro para lograr la formación de tejido de granulación útil, cicatrización por segunda intención y reducir el riesgo de amputación (al 66 %) en pacientes con lesiones del pie diabético avanzado y riesgo de amputación mayor. Los eventos adversos más frecuentes fueron: infección local (19.6 %), ardor y dolor en la zona de inyección (17.1 %), tremor de frío (14.6 %), escalofríos (12.2 %) y fiebre (9.8 %).
Se realizaron además dos estudios observacionales y longitudinales prospectivos. En el primero el Heberprot-P® se extendió a todo el país y se administró a pacientes con úlceras avanzadas, grados 3 o 4 de Wagner, con más de 20 cm2 de extensión como mediana, a dosis de 25 μg, 3 veces por semana hasta obtener granulación completa o un máximo de 8 semanas de tratamiento. Se reportaron los siguientes resultados: 83.9 % de los pacientes lograron respuesta total de granulación, 73 % de los evaluados, con cierre completo de la lesión en 75 días como promedio, 82.8 % no amputados. Los eventos más frecuentes fueron: dolor (20.4 %), ardor (10.8 %), fiebre (9.7 %), escalofríos (7.5 %), tremor de frío (5.4 %), sobregranulación (4.3 %), infección local (4.3 %) y linfangitis (2.2 %).
En el segundo estudio se incluyeron 20 pacientes que fueron tratados con el producto, en la dosis de 75 μg por aplicación, 3 veces por semana, hasta obtener el cierre de la lesión. Se obtuvo respuesta total de granulación en todos los casos en 23 días como promedio. Se reportó el cierre completo de la lesión en el 80 % de los pacientes en 35 días como promedio. Ningún paciente fue amputado. El producto fue bien tolerado. Hubo dos abandonos voluntarios por causas no relacionadas con el producto. Los eventos más frecuentes fueron: ardor en la zona de inyección (45.0 %), tremor de frío (40.0 %), escalofríos (30.0 %), debilidad (25.0 %) e infección local (10.0 %).
Finalmente se hizo un estudio confirmatorio, multicéntrico, aleatorizado, controlado con placebo, a doble ciegas, donde se compararon 3 grupos de tratamiento (Heberprot-P® 75 μg, 25 μg y placebo) en pacientes con úlcera de pie diabético avanzadas (grados 3 y 4 de Wagner, más del 50 % isquémicos y con más de 20 cm2 como mediana de área inicial de las lesiones). El tratamiento se aplicó 3 veces por semana hasta la granulación total u ocho semanas como máximo. La aplicación de Heberprot-P® , a ambos niveles de dosis, ofreció más del 30 % de ventaja sobre el placebo en cuanto a la proporción de pacientes con más de 50 % de su lesión cubierta por tejido de granulación a las dos semanas de tratamiento. Al final del tratamiento la proporción de pacientes con respuesta de granulación completa fue significativamente superior con la dosis de 75 μg (87 %) con relación al placebo (58 %) (IC 95 % para la diferencia: 9.8 %; 47.1 %). El beneficio del tratamiento fue más evidente en los casos de origen neuro-infeccioso “puro” que en los que tenían componente isquémico. El tiempo hasta la respuesta completa fue 3 semanas en ambos grupos que recibieron Heberprot-P® y 5 semanas en el grupo placebo. Esta diferencia fue estadísticamente significativa para ambos niveles de dosis. En el seguimiento hasta 12 meses se obtuvo cierre completo, sin recidivas en el 77 % de los pacientes que habían recibido la dosis de 75 μg por aplicación en 25.4 semanas como promedio, mientras que el 56 % de los que recibieron placebo lograron curar, en 36.2 semanas como promedio (IC 95 % para la diferencia de proporciones: 1.1 %; 41.1 %; prueba log-rank para los tiempos de curación: p = 0.045). El tratamiento fue seguro. No hubo eventos adversos graves asociados al producto en investigación. Los eventos adversos presentados en el estudio y considerados relacionados con el producto fueron: tremor de frío (32 % y 17 % en los grupos de 75 μg y 25 μg, respectivamente) y escalofríos (21 % y 8 %). Otros eventos, asociados más al procedimiento de administración pues aparecieron en proporción similar en el grupo placebo, fueron: dolor (31 % de todos los pacientes) y ardor (24.2 %) en la zona de inyección.
Posteriormente, en la extensión del uso del producto en Cuba se han tratado pacientes con úlceras de pie diabético de cualquier grado de severidad. En el análisis de la información de 1850 pacientes se ha obtenido respuesta de granulación total en el 80.4 % de los pacientes con úlceras grado 1 ó 2 de Wagner, en 3.4 ± 2.7 semanas y en el 75.8 % de los que tenían úlceras grados 3 ó 4 en 4.3 ± 2.9 semanas. La respuesta de granulación fue mejor en los pacientes con úlceras neuropáticas “puras” (86.5 %) que en aquellos con isquemia en su patogenia (64.7 %). En el seguimiento de 1349 de estos pacientes se obtuvo cierre completo de la lesión en el 72.6 % de casos con úlceras grados 1-2 de Wagner y en el 60.4 % de los que tenían úlceras grados 3 ó 4. El 51.3 % de los isquémicos y el 73.1 % de los neuropáticos “puros” curaron la lesión completamente.
-
 Precauciones
PrecaucionesCONTRAINDICACIONES:
El Heberprot-P® se encuentra contraindicado en:- Pacientes con antecedentes de hipersensibilidad al producto o a cualquiera de sus componentes
- Pacientes con eventos cardiovasculares agudos como: infarto agudo del miocardio, angina de pecho severa, accidente cerebrovascular agudo o isquemia transitoria o eventos tromboembólicos en los dos meses previos
- Pacientes con insuficiencia cardíaca congestiva severa (NYHA III y IV), bloqueo aurículo- ventricular severo (grado III) y fibrilación auricular con ritmo descontrolado
- Pacientes con historia personal o sospecha de enfermedades malignas
- Pacientes con coma diabético o cetoacidosis diabética
PRECAUCIONES:
La administración de productos biológicos debe ser cuidadosa y tomar las medidas necesarias en caso de eventos adversos inesperados. Antes de usar Heberprot-P® se deben tratar condiciones coexistentes, tales como: infección y osteomielitis. En los pacientes con isquemia severa por macroangiopatía periférica se debe realizar algún procedimiento de reperfusión del miembro afectado.
Se desconoce si Heberprot-P® pasa a la leche materna. No se recomienda su uso en las madres lactantes. Hasta el momento no se dispone de datos suficientes que avalen su uso en embarazadas y pacientes pediátricos, por lo que el médico debe hacer un balance riesgo- beneficio en cada caso.
Se debe administrar con precaución en pacientes con antecedentes personales de eventos cardiovasculares agudos tales como: infarto agudo del miocardio, accidente cerebrovascular o isquemia transitoria o tromboembolismo; así como en pacientes con enfermedad valvular clínicamente relevante (i.e. válvulas aórticas calcificadas), hipertensión arterial severa e historia de trombosis venosa.
Se debe administrar con precaución en pacientes con insuficiencia renal con creatinina mayor de 200 μmol/ L, por lo que el médico debe hacer un balance riesgo-beneficio en cada caso.
Se debe realizar un tratamiento precoz y adecuado de la infección de la lesión previa al uso de Heberprot-P®.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES DE USO:
El tratamiento debe ser realizado por un personal especializado, que disponga de instalaciones diagnósticas necesarias, así como de experiencia suficiente en el tratamiento del pie diabético. Este medicamento sólo podrá utilizarse hasta la fecha de caducidad indicada en el envase.
Las soluciones diluidas de Heberprot-P® deben administrarse inmediatamente después de su preparación.
EVENTOS ADVERSOS
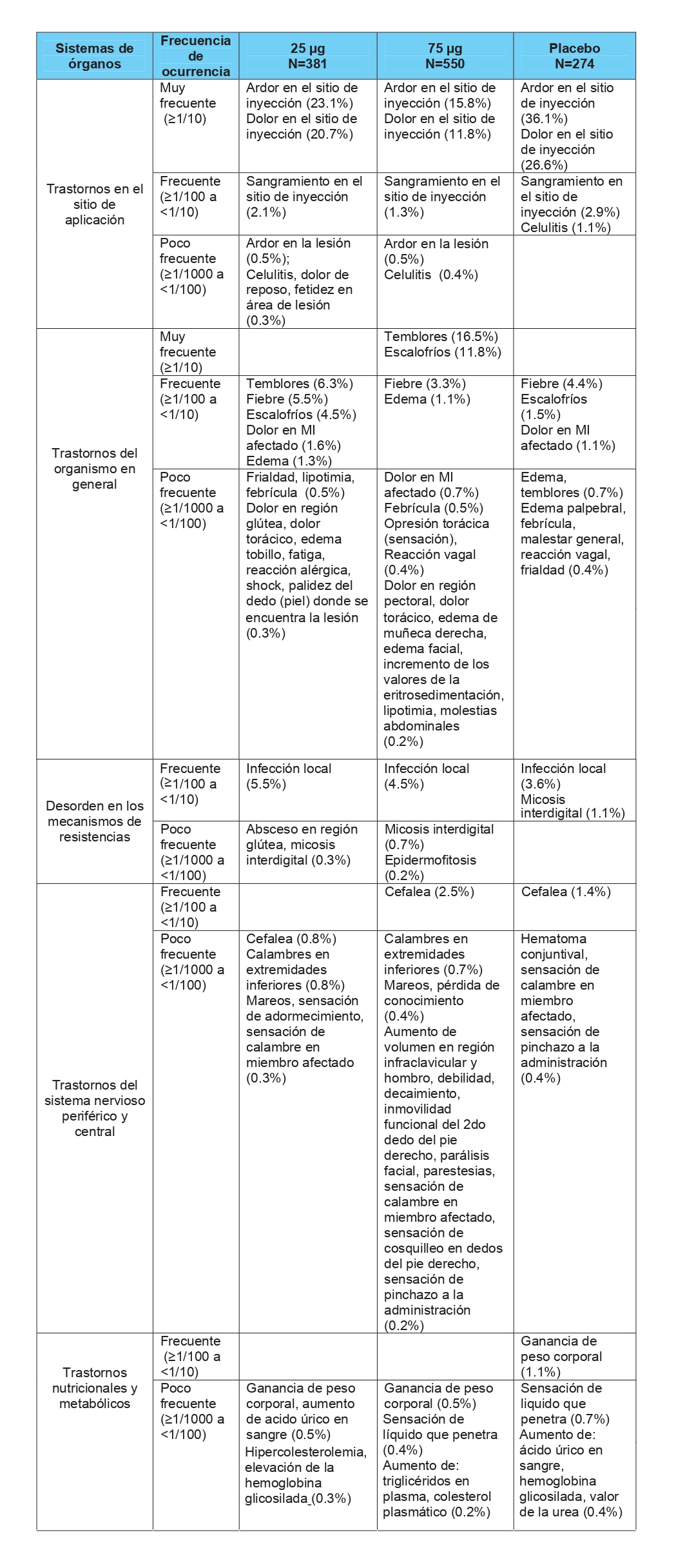
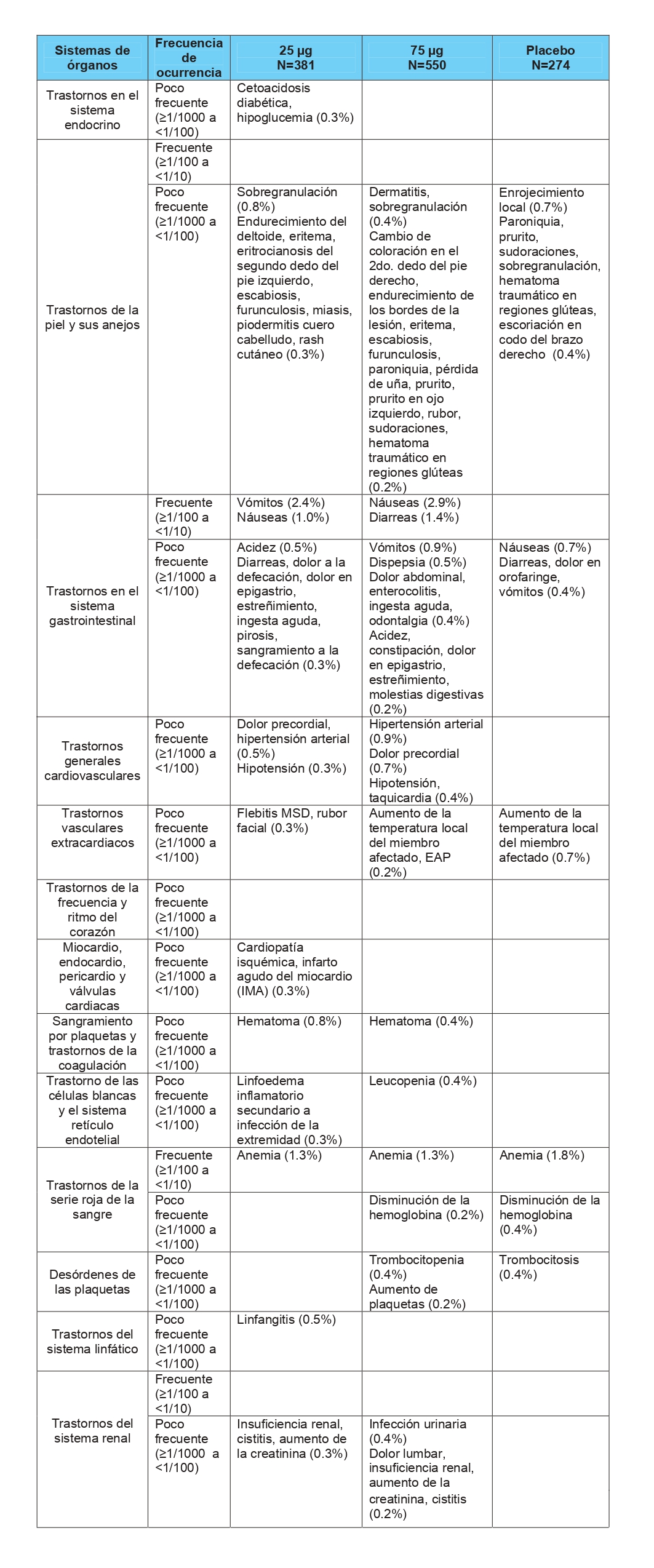
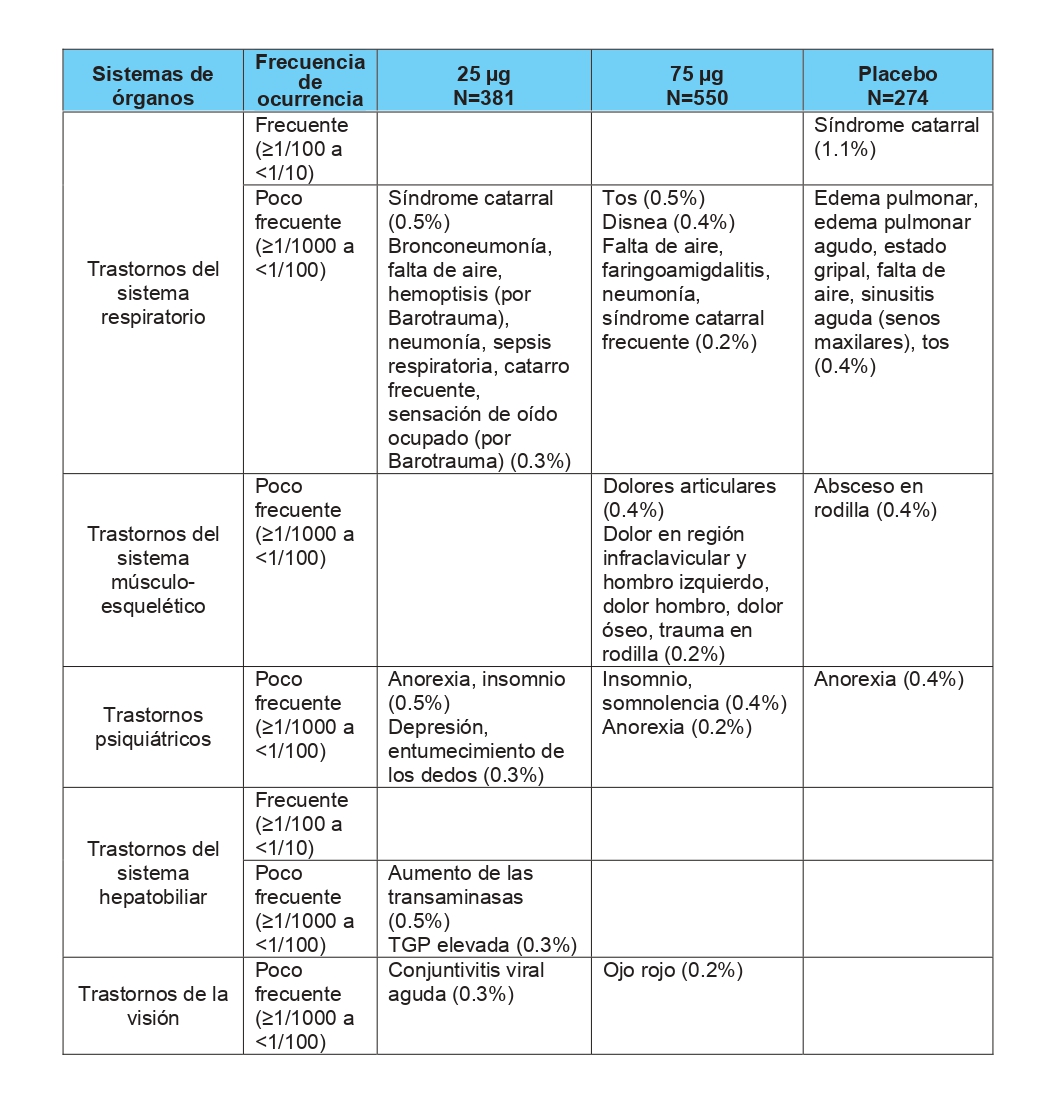
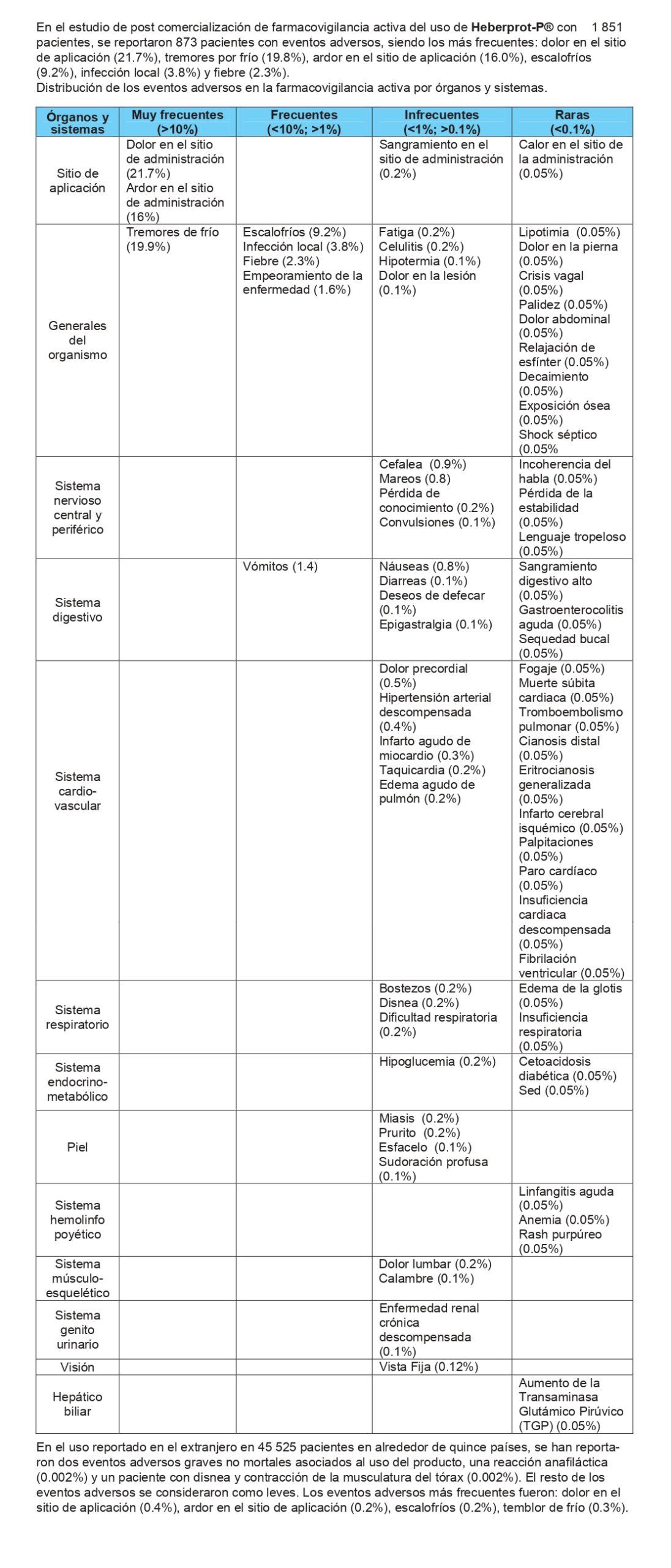
Los eventos adversos más frecuentes reportados son: dolor y ardor en el sitio de aplicación, escalofríos, tremores de frio, infección local y fiebre.

En la tabla siguiente se presenta la frecuencia acumulada de aparición de los eventos adversos en los diferentes ensayos clínicos realizados con Heberprot-P® según el tipo de evento organizado por órganos/sistemas.




Interacciones con otros productos medicinales y otras formas de interacción:
No se conoce si Heberprot-P® interacciona con otros medicamentos de uso tópico, es por elloque se recomienda no aplicarlo con otros productos tópicos.
Uso en embarazo y lactancia:
Embarazo: No se disponen de datos suficientes que avalen su uso en embarazadas.
Lactancia: Se desconoce si Heberprot-P® pasa a la leche materna. No se recomienda el uso en madres lactantes.
Efectos sobre la conducción de vehículos / maquinarias:
Los pacientes que están en tratamiento con Heberprot-P® no deben conducir vehículos nimaquinarias.
Sobredosis:
No se ha producido ningún caso de sobredosis ni se conocen antídotos para este producto. Por la aplicación local de Heberprot-P® y por el compromiso circulatorio de los pacientes diabéticos con lesiones avanzadas, es poco probable que puedan producirse efectos sistémicos.
-
 Posología y modo de administración
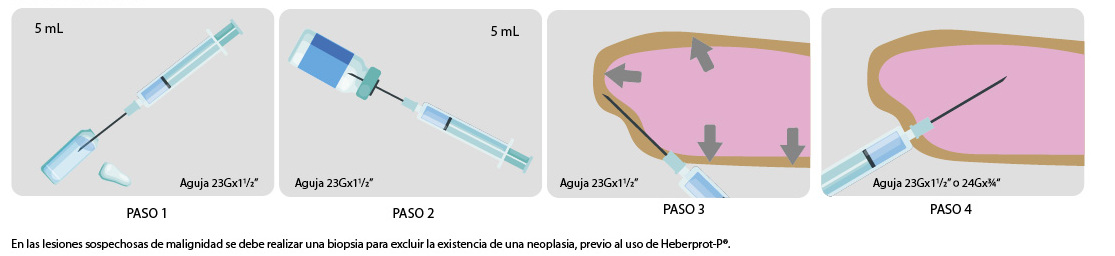
Posología y modo de administraciónHeberprot-P® debe utilizarse siempre unido al cuidado adecuado de la úlcera del pie diabético, dado por el desbridamiento oportuno de las lesiones, alivio de las zonas de presión y las curas sistemáticas. Se debe realizar el diagnóstico y el tratamiento precoz y adecuado de la infección de la úlcera, previo al uso de Heberprot-P® . En las lesiones sospechosas de malignidad se debe realizar una biopsia para excluir la existencia de una neoplasia, previo al uso de Heberprot-P® .
Heberprot-P® se administrará a razón de 25 ó 75 μg diluido en 5 mL de agua para inyección, 3 veces por semana por vía intralesional. En caso de lesiones con un área superior a 20 cm2 o con signos de isquemia (ausencia de pulsos; índice de presiones tobillo/brazo < 0.8) se recomienda
administrar la dosis de 75 μg. Las administraciones se mantendrán hasta que se logre granulación completa de la lesión, cierre de esta mediante injerto o se alcance un máximo de 8 semanas de tratamiento.
Se debe descontinuar el tratamiento en los casos que se alcance tejido de granulación útil que cubra toda la extensión de la lesión o se logre una reducción del área hasta menos de 1 cm2.
Las infiltraciones deben hacerse después de la cura de las lesiones: en los bordes de las úlceras, con agujas de 26Gx1⁄2” y en el fondo, en caso de lesiones profundas deben usarse agujas de 24Gx11⁄2”. Se deben infiltrar primero las zonas más limpias de las lesiones y se debe cambiar de aguja en los diferentes sitios de punción a fin de evitar la transmisión de la posible infección de un sitio a otro. Posteriormente, la lesión debe cubrirse con un apósito de gasa humedecido con solución salina que mantenga el ambiente húmedo y limpio.
VIDEO

Si después de 3 semanas de tratamiento continuado no existe formación de tejido de granulación útil en el lecho de la úlcera, se debe re-evaluar el tratamiento y valorar otros factores que puedan dificultar la cicatrización, entre ellos la osteomielitis, la infección local y el descontrol metabólico.
Instrucciones de uso, manipulación y destrucción del remanente no utilizable del producto:
- Utilizar cada bulbo de Heberprot-P® para un solo paciente.
- Se debe tener cuidado para evitar deterioros y contaminación bacteriana de los bulbos.
- El personal que administra el producto debe lavarse las manos adecuadamente y colocarse guantes antes de la aplicación del Heberprot-P ®.
- Se debe ser cuidadoso para evitar la extensión de la infección en las lesiones. Se recomienda el cambio de aguja para la aplicación en diferentes partes de la lesión.
- Una vez terminado el tratamiento se debe desechar el medicamento restante.
Fecha de aprobación / revisión del texto: 5 de enero de 2015.
La ulceración del pie es una complicación significativa de la diabetes con una incidencia anual ligeramente superior al 2% en todos los pacientes con diabetes, la cual se eleva entre 5.0 y 7.5% en los que presentan neuropatía periférica.[I] Se estima que un 15% de los pacientes con diabetes desarrollarán úlceras en algún momento de su vida. La mortalidad a los 5 años de los pacientes a los que se les practica una amputación de miembros inferiores es de 50-60%.[II]
El tratamiento de un paciente con úlceras del pie diabético incluye lo siguiente: control metabólico, eliminción de los sitios de presión, desbridamiento del tejido necrótico, empleo de apósitos y el tratamiento antimicrobiano de las infecciones. Además debe evaluarse la posible indicación de otras terapias más específicas como los injertos de piel o los sustitutos artificiales de piel obtenidos por técnicas de ingeniería de tejidos, los factores de crecimiento y el empleo de métodos de revascularización. No obstante, esta complicación constituye un problema médico no resuelto ppues un número importante de pacientes evolucionan a la amputación especialmente aquellos con lesiones en los grados avanzados.
El Heberprot-P® es un medicamento desarrollado por el Centro de Ingeniería Genética y Biotecnología de La Habana (CIGB) para tratamiento de las úlceras del pie diabético (UPD). Este producto, basado en factor de crecimiento epidérmico humano, recombinante (rhuEGF), con el cual el CICB tiene una larga tradición productiva, estimula la pproliferación de fibroblastos, queratinocitos y células endoteliales de vasos, lo cual contribuye a sus propiedades cicatrizantes.
Propiedades Físicas, Químicas y Farmacéuticas
Categoría Farmacológica:
Agente estimulante de la cicatrización y citoprotector.
Nombre comercial:
Heberprot-P®
Nombre Genérico:
Factor de crecimiento epidérmico humano recombinante (FCEhrec)
Nombre Químico:
Factor de crecimiento epidérmico humano recombinante (FCEhrec)
Similar Comercial: No existe.
Forma farmacéutica:
Inyectable presentado en forma liofilizado en bulbos de vidrio.
Vía de administración:
Administración parental, por vía intralesional y perilesional.
Características del Envase: El producto se presenta en:
Frasco ampolla de vidrio hidrolítico, incoloro, tapón de goma, precinto de aluminio y tapa flip off.
Estuche múltiple para 6 ampollas de vidrio I incoloro de Heberprot-p®.
Se presneta en dosis de 75 μg.
Composición del producto: Cada bulbo de 5 ml contiene:
Factor de Crecimiento Epidérmico humano recombinante (FCEhr) 0,075mg
Sacarosa 15,000 mg
Dextran 40 5,000 mg
Hidrogenofosfato de disodio 0,454 mg
Dihidrogenofosfato de sodio dihidratado 1,061mg
Agua para inyección 5ml
Condiciones de almacenamiento:
Consérvese a temperatura de 2º C a 8º C.
El efecto del Factor de Crecimiento Epidérmico (FCE) ha sido ampliamente estudiado en el proceso de cicatrización. El mismo es una molécula proteica, sencilla, que tiene un peso molecular de 6045 daltons, un punto isoeléctrico de 4.6 y consta de 53 aminoácidos. Estimula tanto la proliferación de fibroblastos como de células epiteliales. Presenta potente actividad mitogénica in-vivo sobre las células epidérmicas, musculares lisas de los vasos, fibroblastos y queratinocitos, entre otras.
Los primeros efectos biológicos atribuidos al FCE fueron la apertura precoz de los párpados y la erupción temprana de la dentición cuando se administraba por vía parenteral a ratones recién nacidos. Posteriormente fue aislado por Cohen y Carpenter de la orina humana y después de esto se ha reportado su detección en varios de los fluidos del organismo humano como suero, saliva, jugo gastroduodenal, calostro, líquido amniótico y seminal.
Propiedades FARMACOCINÉTICAS (absorción, distribución, biotransformación, eliminación):
Los niveles fisiológicos de FCE en plasma no son detectables, pero las plaquetas contienen niveles sustanciales (aproximadamente 500 pmol/ 1012 plaquetas). Después de la coagulación, las concentraciones de FCE alcanzan los 130 pmol/L, lo cual es suficiente para inducir la mitosis y migración celular. Esta molécula regula el crecimiento, la diferenciación y metabolismo de varias células.
Estimula la migración y proliferación de fibroblastos que permiten la síntesis y depósito de colágeno. También son quimioatrayentes y mitógenos de células endoteliales y epiteliales.
Los perfiles farmacocinéticos (FK) del 125I-FCEhr administrado, su distribución en órganos y vías de eliminación han sido objeto de análisis. Se realizaron estudios en ratas y perros tras una administración única, tanto por vía tópica como endovenosa. Los mayores niveles, expresados en ng equivalentes por gramo de tejido, se alcanzaron en riñones, hígado, piel y estómago. Según los datos de radiactividad, a las 96 horas se detecta aún eliminación de un valor correspondiente al 78 % del producto en la orina. El comportamiento cinético del FCEhr tras la administración i.v. se caracteriza por una rápida fase de distribución seguida de una fase de eliminación más lenta, tanto para sangre como para plasma. Se ha demostrado que el hígado y el riñón son los dos órganos clave responsables de la fase rápida de distribución. La concentración sanguínea resultó siempre inferior a la plasmática.
El FCEhrec no se distribuye en la fracción celular sanguínea, hecho esperable por la conocida carencia de receptores en estas estirpes celulares. El FCEhr sufre una rápida e importante degradación en el organismo antes de ser excretado por la orina, principal vía de eliminación según estos resultados. Se ha planteado que el riñón es el principal órgano que participa en la captación y el metabolismo de FCEhr. Apenas existe paso del FCEhr a la circulación cuando se administra tópicamente, tanto en los animales con piel intacta como en los que sufrieron lesión.
En un estudio de farmacocinética después de la administración intralesional de Heberprot-P® 25 μg o 75 μg, 3 veces por semana en pacientes con úlceras de pie diabético grados 1 y 2 de Wagner se alcanzaron los niveles plasmáticos de FCEhr máximos a los 5-15 minutos de administrado (Tmax.). La eliminación fue rápida, en alrededor de 2 horas. Los valores promedio de AUC para 25 μg fueron 85.1 pg.h/ mL, tanto después de la primera (período I), como después de haber recibido más de 15 administraciones (período II), mientras que para 75 μg fueron 197.8 y 243 pg.h/ mL en los períodos I y II respectivamente, lo que indica que no hubo acumulación de FCEhr durante el tratamiento. No se observaron diferencias entre las dosis en los t1/2 ni en el tiempo de residencia medio en el cuerpo, próximos a 1 hora. No se detectó en orina aumento en la eliminación de FCEhr en las 48 horas siguientes a la administración, comparado con el grupo que recibió placebo, por lo que el FCEhr en orina debe corresponder al producido endógenamente. En este estudio se obtuvo cierre total de las úlceras en el 87.5 % de los pacientes a las 12 semanas después de iniciado el tratamiento con cualquiera de las dosis.
Propiedades FARMACODINÁMICAS
El FCE ejerce su acción mediante la unión a un receptor específico ubicado en la membrana de las células blanco. El receptor es una glicoproteína con actividad tirosina quinasa. Se ha reportado la presencia de este receptor en varias líneas celulares humanas excepto en las células hematopoyéticas. Se encuentra en abundancia relativa en la piel.
Varios estudios de farmacodinamia experimental se han realizado aplicando el FCEhr por vía parenteral en los que se han puesto de manifiesto su papel protector y trófico. En ratas sometidas a una axotomía total transversal del nervio ciático a la altura de la región coxofemoral se demostró el efecto neuroprotector de la inyección perilesional de FCEhr mediante la estimulación de la respuesta de regeneración morfofuncional del axón y de síntesis de mielina por el nervio y sus células. En dos estudios independientes y extemporáneos se demostró que el tratamiento: a) favoreció el restablecimiento de la conducción nerviosa motora a los 60 días de provocado el trauma después de un tratamiento con FCEhr durante 20 días; b) favoreció la recuperación del axón y de la mielina y previno o atenuó los cambios sugerentes de degeneración intraxonal; c) previno o postergó el debut de cambios tróficos de los tejidos blandos de la extremidad (piel y anejos) como la aparición de úlceras plantares y la necrosis de los dedos.
En dos estudios realizados en roedores, en un caso con quemaduras hipodérmicas de aproximadamente 8-9 % y en otro de daño multiorgánico inducido por tioacetamida, se obtuvo disminución de la letalidad y menor magnitud del daño gastrointestinal y renal en los animales tratados con una dosis de 30 μg/ kg de FCEhr intraperitoneal, con respecto al control. Por otro lado, se ha evidenciado protección dosis-efecto del FCEhr en modelos de daño hepático y de isquemia/ reperfusión en riñón, al ensayar dosis de 500 y 750 μg/ Kg por vía peritoneal. Los marcadores de estrés oxidativo, como el malonil dialdehído, fueron significativamente menores en los grupos tratados.
En biopsias del tejido de granulación de pacientes tratados con el Heberprot-P® se ha observado neoangiogénesis de microvasculatura en casos isquémicos y una reacción proliferativa en los neuropáticos.
Indicaciones terapéuticas
Sólo debe usarse bajo PRESCRIPCIÓN FACULTATIVA
El Heberprot-P® está indicado, junto a otras terapias convencionales, para el manejo del pie diabético en pacientes con úlceras neuropáticas e isquémicas, con un área superior a 1 cm2, para estimular la formación de tejido de granulación útil que permita el cierre por segunda intención o mediante autoinjerto de piel según ha sido demostrado en varios estudios clínicos.
En el primer estudio piloto en 14 pacientes con úlceras de pie diabético entre 21 y 78 cm2, grados 3 y 4 según la clasificación de Wagner, la mayoría isquémicos y sin otra alternativa terapéutica, se administró Heberprot-P® 25 μg por vía intralesional, 3 veces/ semana, hasta lograr la formación de tejido de granulación o un máximo de 20 aplicaciones. Se obtuvo respuesta total (>75 % de la superficie de la úlcera cubierta por tejido de granulación) en 7 (50 %) pacientes en 33 días como promedio, quienes lograron el cierre completo de la lesión (en 57 días como promedio) y la prevención de la amputación. Solamente se observó recurrencia en un paciente luego del seguimiento de un año. El producto fue seguro, reportándose como principal evento adverso el dolor en la zona de inyección.
Seguidamente se realizó un ensayo multicéntrico, a doble ciegas, aleatorizado entre los niveles de 25 μg y 75 μg en cada aplicación, tres veces por semana hasta la granulación completa u ocho semanas. Se incluyeron 41 pacientes, con lesiones con una extensión de más de 20 cm2 como mediana, grados 3 y 4 según Wagner, más del 50 % isquémicos. Se obtuvo respuesta completa de granulación en el 82.6 % y 61.1 % de los pacientes a las 3.8 y 4.9 semanas de tratamiento como mediana en los grupos de 75 μg y 25 μg respectivamente. La epitelización completa a las 20 semanas después del inicio del tratamiento ocurrió en el 56 % y 50 % de los pacientes. En el seguimiento al año un paciente del grupo de 75 μg tuvo recidiva de la lesión. Se concluyó que el producto es efectivo y seguro para lograr la formación de tejido de granulación útil, cicatrización por segunda intención y reducir el riesgo de amputación (al 66 %) en pacientes con lesiones del pie diabético avanzado y riesgo de amputación mayor. Los eventos adversos más frecuentes fueron: infección local (19.6 %), ardor y dolor en la zona de inyección (17.1 %), tremor de frío (14.6 %), escalofríos (12.2 %) y fiebre (9.8 %).
Se realizaron además dos estudios observacionales y longitudinales prospectivos. En el primero el Heberprot-P® se extendió a todo el país y se administró a pacientes con úlceras avanzadas, grados 3 o 4 de Wagner, con más de 20 cm2 de extensión como mediana, a dosis de 25 μg, 3 veces por semana hasta obtener granulación completa o un máximo de 8 semanas de tratamiento. Se reportaron los siguientes resultados: 83.9 % de los pacientes lograron respuesta total de granulación, 73 % de los evaluados, con cierre completo de la lesión en 75 días como promedio, 82.8 % no amputados. Los eventos más frecuentes fueron: dolor (20.4 %), ardor (10.8 %), fiebre (9.7 %), escalofríos (7.5 %), tremor de frío (5.4 %), sobregranulación (4.3 %), infección local (4.3 %) y linfangitis (2.2 %).
En el segundo estudio se incluyeron 20 pacientes que fueron tratados con el producto, en la dosis de 75 μg por aplicación, 3 veces por semana, hasta obtener el cierre de la lesión. Se obtuvo respuesta total de granulación en todos los casos en 23 días como promedio. Se reportó el cierre completo de la lesión en el 80 % de los pacientes en 35 días como promedio. Ningún paciente fue amputado. El producto fue bien tolerado. Hubo dos abandonos voluntarios por causas no relacionadas con el producto. Los eventos más frecuentes fueron: ardor en la zona de inyección (45.0 %), tremor de frío (40.0 %), escalofríos (30.0 %), debilidad (25.0 %) e infección local (10.0 %).
Finalmente se hizo un estudio confirmatorio, multicéntrico, aleatorizado, controlado con placebo, a doble ciegas, donde se compararon 3 grupos de tratamiento (Heberprot-P® 75 μg, 25 μg y placebo) en pacientes con úlcera de pie diabético avanzadas (grados 3 y 4 de Wagner, más del 50 % isquémicos y con más de 20 cm2 como mediana de área inicial de las lesiones). El tratamiento se aplicó 3 veces por semana hasta la granulación total u ocho semanas como máximo. La aplicación de Heberprot-P® , a ambos niveles de dosis, ofreció más del 30 % de ventaja sobre el placebo en cuanto a la proporción de pacientes con más de 50 % de su lesión cubierta por tejido de granulación a las dos semanas de tratamiento. Al final del tratamiento la proporción de pacientes con respuesta de granulación completa fue significativamente superior con la dosis de 75 μg (87 %) con relación al placebo (58 %) (IC 95 % para la diferencia: 9.8 %; 47.1 %). El beneficio del tratamiento fue más evidente en los casos de origen neuro-infeccioso “puro” que en los que tenían componente isquémico. El tiempo hasta la respuesta completa fue 3 semanas en ambos grupos que recibieron Heberprot-P® y 5 semanas en el grupo placebo. Esta diferencia fue estadísticamente significativa para ambos niveles de dosis. En el seguimiento hasta 12 meses se obtuvo cierre completo, sin recidivas en el 77 % de los pacientes que habían recibido la dosis de 75 μg por aplicación en 25.4 semanas como promedio, mientras que el 56 % de los que recibieron placebo lograron curar, en 36.2 semanas como promedio (IC 95 % para la diferencia de proporciones: 1.1 %; 41.1 %; prueba log-rank para los tiempos de curación: p = 0.045). El tratamiento fue seguro. No hubo eventos adversos graves asociados al producto en investigación. Los eventos adversos presentados en el estudio y considerados relacionados con el producto fueron: tremor de frío (32 % y 17 % en los grupos de 75 μg y 25 μg, respectivamente) y escalofríos (21 % y 8 %). Otros eventos, asociados más al procedimiento de administración pues aparecieron en proporción similar en el grupo placebo, fueron: dolor (31 % de todos los pacientes) y ardor (24.2 %) en la zona de inyección.
Posteriormente, en la extensión del uso del producto en Cuba se han tratado pacientes con úlceras de pie diabético de cualquier grado de severidad. En el análisis de la información de 1850 pacientes se ha obtenido respuesta de granulación total en el 80.4 % de los pacientes con úlceras grado 1 ó 2 de Wagner, en 3.4 ± 2.7 semanas y en el 75.8 % de los que tenían úlceras grados 3 ó 4 en 4.3 ± 2.9 semanas. La respuesta de granulación fue mejor en los pacientes con úlceras neuropáticas “puras” (86.5 %) que en aquellos con isquemia en su patogenia (64.7 %). En el seguimiento de 1349 de estos pacientes se obtuvo cierre completo de la lesión en el 72.6 % de casos con úlceras grados 1-2 de Wagner y en el 60.4 % de los que tenían úlceras grados 3 ó 4. El 51.3 % de los isquémicos y el 73.1 % de los neuropáticos “puros” curaron la lesión completamente.
CONTRAINDICACIONES:
El Heberprot-P® se encuentra contraindicado en:
- Pacientes con antecedentes de hipersensibilidad al producto o a cualquiera de sus componentes
- Pacientes con eventos cardiovasculares agudos como: infarto agudo del miocardio, angina de pecho severa, accidente cerebrovascular agudo o isquemia transitoria o eventos tromboembólicos en los dos meses previos
- Pacientes con insuficiencia cardíaca congestiva severa (NYHA III y IV), bloqueo aurículo- ventricular severo (grado III) y fibrilación auricular con ritmo descontrolado
- Pacientes con historia personal o sospecha de enfermedades malignas
- Pacientes con coma diabético o cetoacidosis diabética
PRECAUCIONES:
La administración de productos biológicos debe ser cuidadosa y tomar las medidas necesarias en caso de eventos adversos inesperados. Antes de usar Heberprot-P® se deben tratar condiciones coexistentes, tales como: infección y osteomielitis. En los pacientes con isquemia severa por macroangiopatía periférica se debe realizar algún procedimiento de reperfusión del miembro afectado.
Se desconoce si Heberprot-P® pasa a la leche materna. No se recomienda su uso en las madres lactantes. Hasta el momento no se dispone de datos suficientes que avalen su uso en embarazadas y pacientes pediátricos, por lo que el médico debe hacer un balance riesgo- beneficio en cada caso.
Se debe administrar con precaución en pacientes con antecedentes personales de eventos cardiovasculares agudos tales como: infarto agudo del miocardio, accidente cerebrovascular o isquemia transitoria o tromboembolismo; así como en pacientes con enfermedad valvular clínicamente relevante (i.e. válvulas aórticas calcificadas), hipertensión arterial severa e historia de trombosis venosa.
Se debe administrar con precaución en pacientes con insuficiencia renal con creatinina mayor de 200 μmol/ L, por lo que el médico debe hacer un balance riesgo-beneficio en cada caso.
Se debe realizar un tratamiento precoz y adecuado de la infección de la lesión previa al uso de Heberprot-P®.
ADVERTENCIAS ESPECIALES Y PRECAUCIONES DE USO:
El tratamiento debe ser realizado por un personal especializado, que disponga de instalaciones diagnósticas necesarias, así como de experiencia suficiente en el tratamiento del pie diabético. Este medicamento sólo podrá utilizarse hasta la fecha de caducidad indicada en el envase.
Las soluciones diluidas de Heberprot-P® deben administrarse inmediatamente después de su preparación.
EVENTOS ADVERSOS
Los eventos adversos más frecuentes reportados son: dolor y ardor en el sitio de aplicación, escalofríos, tremores de frio, infección local y fiebre.
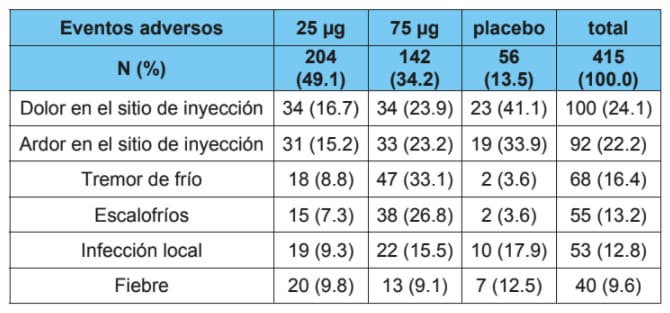
En la tabla siguiente se presenta la frecuencia acumulada de aparición de los eventos adversos en los diferentes ensayos clínicos realizados con Heberprot-P® según el tipo de evento organizado por órganos/sistemas.
Interacciones con otros productos medicinales y otras formas de interacción:
No se conoce si Heberprot-P® interacciona con otros medicamentos de uso tópico, es por ello
que se recomienda no aplicarlo con otros productos tópicos.
Uso en embarazo y lactancia:
Embarazo: No se disponen de datos suficientes que avalen su uso en embarazadas.
Lactancia: Se desconoce si Heberprot-P® pasa a la leche materna. No se recomienda el uso en madres lactantes.
Efectos sobre la conducción de vehículos / maquinarias:
Los pacientes que están en tratamiento con Heberprot-P® no deben conducir vehículos ni
maquinarias.
Sobredosis:
No se ha producido ningún caso de sobredosis ni se conocen antídotos para este producto. Por la aplicación local de Heberprot-P® y por el compromiso circulatorio de los pacientes diabéticos con lesiones avanzadas, es poco probable que puedan producirse efectos sistémicos.
Heberprot-P® debe utilizarse siempre unido al cuidado adecuado de la úlcera del pie diabético, dado por el desbridamiento oportuno de las lesiones, alivio de las zonas de presión y las curas sistemáticas. Se debe realizar el diagnóstico y el tratamiento precoz y adecuado de la infección de la úlcera, previo al uso de Heberprot-P® . En las lesiones sospechosas de malignidad se debe realizar una biopsia para excluir la existencia de una neoplasia, previo al uso de Heberprot-P® .
Heberprot-P® se administrará a razón de 25 ó 75 μg diluido en 5 mL de agua para inyección, 3 veces por semana por vía intralesional. En caso de lesiones con un área superior a 20 cm2 o con signos de isquemia (ausencia de pulsos; índice de presiones tobillo/brazo < 0.8) se recomienda
administrar la dosis de 75 μg. Las administraciones se mantendrán hasta que se logre granulación completa de la lesión, cierre de esta mediante injerto o se alcance un máximo de 8 semanas de tratamiento.
Se debe descontinuar el tratamiento en los casos que se alcance tejido de granulación útil que cubra toda la extensión de la lesión o se logre una reducción del área hasta menos de 1 cm2.
Las infiltraciones deben hacerse después de la cura de las lesiones: en los bordes de las úlceras, con agujas de 26Gx1⁄2” y en el fondo, en caso de lesiones profundas deben usarse agujas de 24Gx11⁄2”. Se deben infiltrar primero las zonas más limpias de las lesiones y se debe cambiar de aguja en los diferentes sitios de punción a fin de evitar la transmisión de la posible infección de un sitio a otro. Posteriormente, la lesión debe cubrirse con un apósito de gasa humedecido con solución salina que mantenga el ambiente húmedo y limpio.
VIDEO
Si después de 3 semanas de tratamiento continuado no existe formación de tejido de granulación útil en el lecho de la úlcera, se debe re-evaluar el tratamiento y valorar otros factores que puedan dificultar la cicatrización, entre ellos la osteomielitis, la infección local y el descontrol metabólico.
Instrucciones de uso, manipulación y destrucción del remanente no utilizable del producto:
- Utilizar cada bulbo de Heberprot-P® para un solo paciente.
- Se debe tener cuidado para evitar deterioros y contaminación bacteriana de los bulbos.
- El personal que administra el producto debe lavarse las manos adecuadamente y colocarse guantes antes de la aplicación del Heberprot-P ®.
- Se debe ser cuidadoso para evitar la extensión de la infección en las lesiones. Se recomienda el cambio de aguja para la aplicación en diferentes partes de la lesión.
- Una vez terminado el tratamiento se debe desechar el medicamento restante.
Fecha de aprobación / revisión del texto: 5 de enero de 2015.